大家好,欢迎来到IT知识分享网。
2025年7月4日,CDE发布“关于公开征求药品电子通用技术文档(eCTD)相关技术文件和申报资料目录层级对应表意见的通知”,进一步推动eCTD在我国的全面实施。
易迪希针对本轮(2025年7月)及2023年1月CDE发布的征求意见稿,与原始V1.0版本进行了系统化对比分析,旨在帮助读者朋友精准把握eCTD申报的技术要点,实时适配监管动态。
1、删除2.8章节关于纸质资料的递交要求、删除4.1.2章节和附件说明函中关于纸质资料的相关内容,包括“关于纸质资料与eCTD申报资料内容一致的承诺”和“关于按规定时限一次性提交全部纸质申报资料的承诺”;
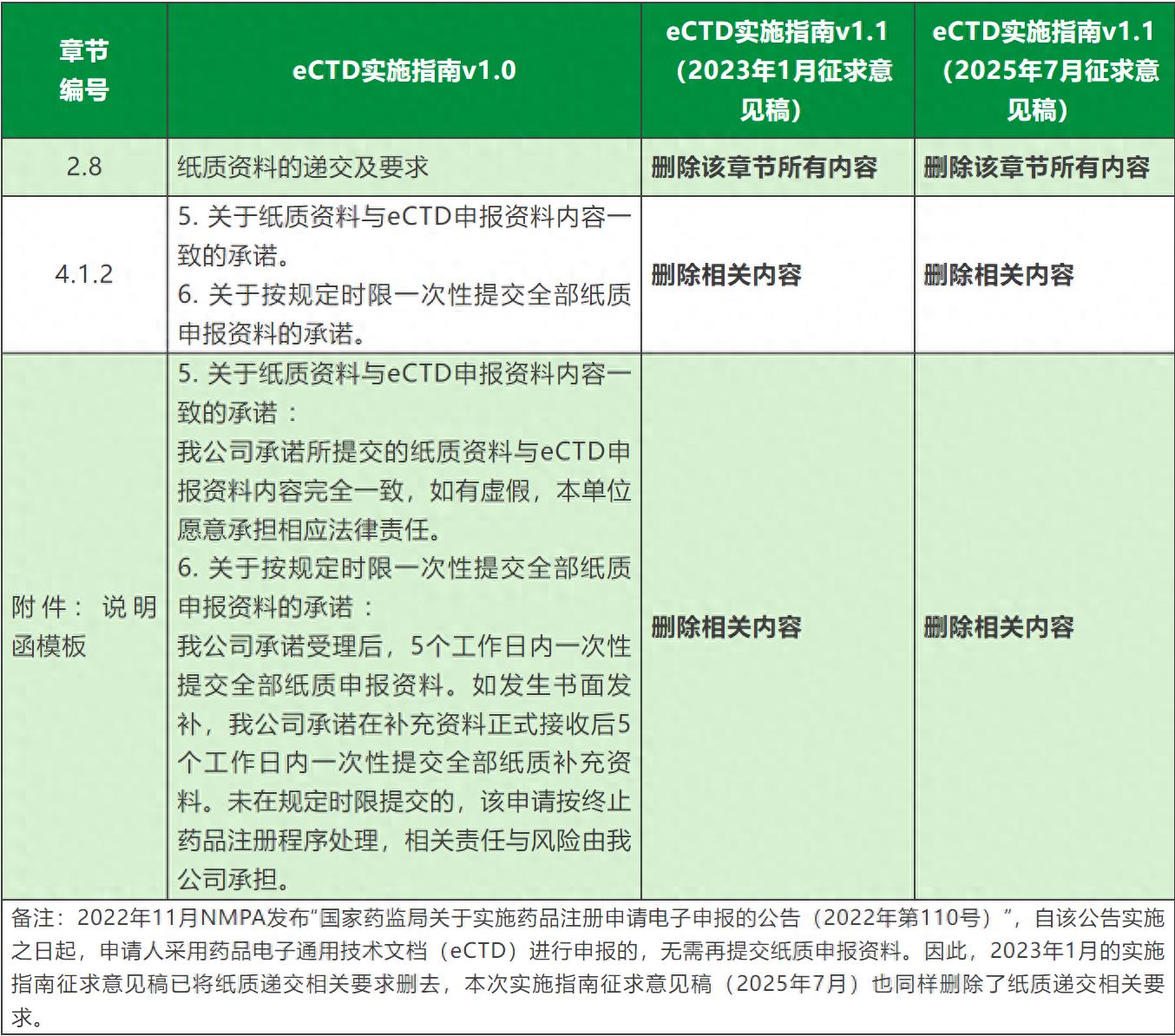
2、修改7.6章节关于文件大小的要求,将单个PDF文件应控制在500MB以内修改为200MB;
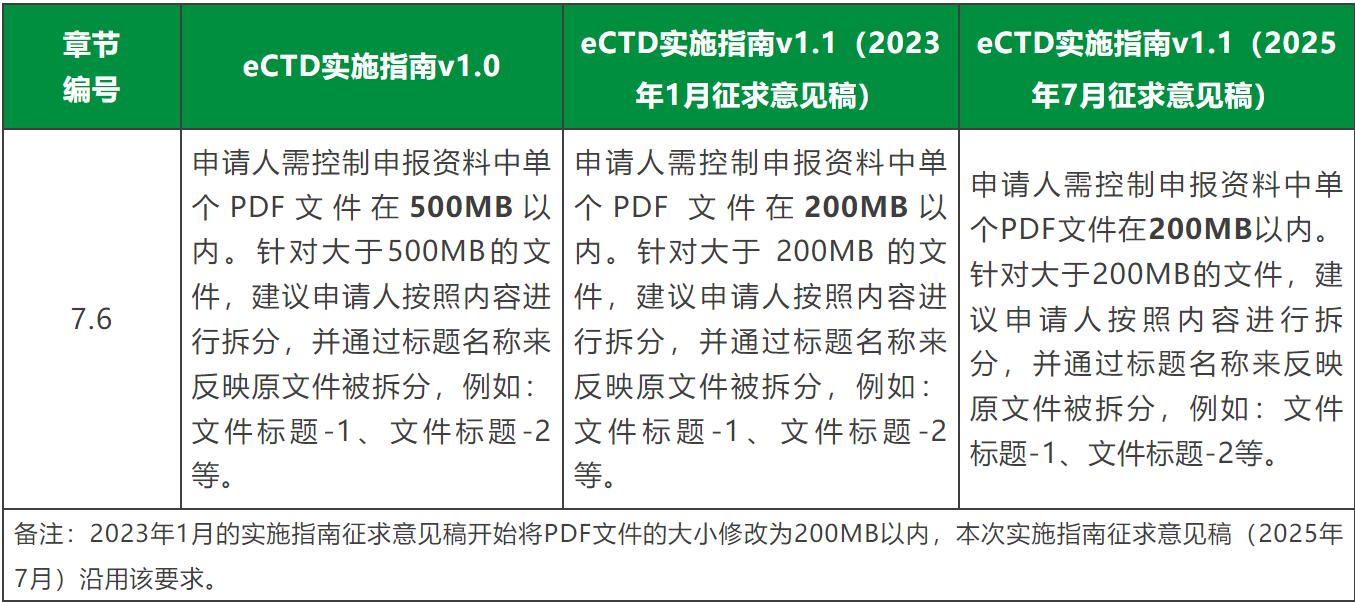
3、修改关于纸质递交的描述,将“纸质递交”修改为“非eCTD方式提交”;
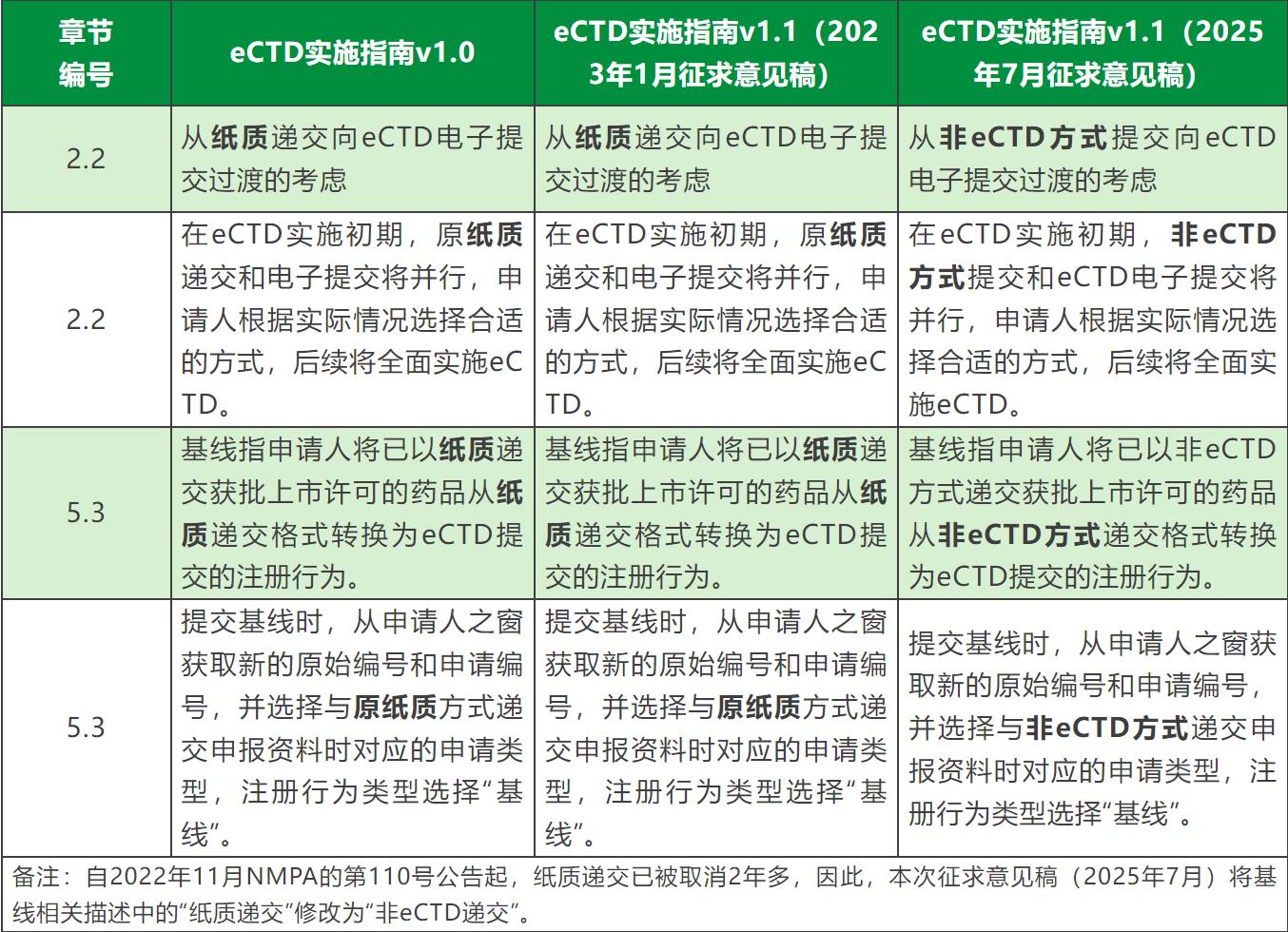
4、修改关于电子签名的描述,将“电子签名”修改为“电子签章”,修改对PDF文件进行电子签章的要求;
5、新增原料药申请的申请编号编码规则,2.4章节关于原料药申请的对应关系;
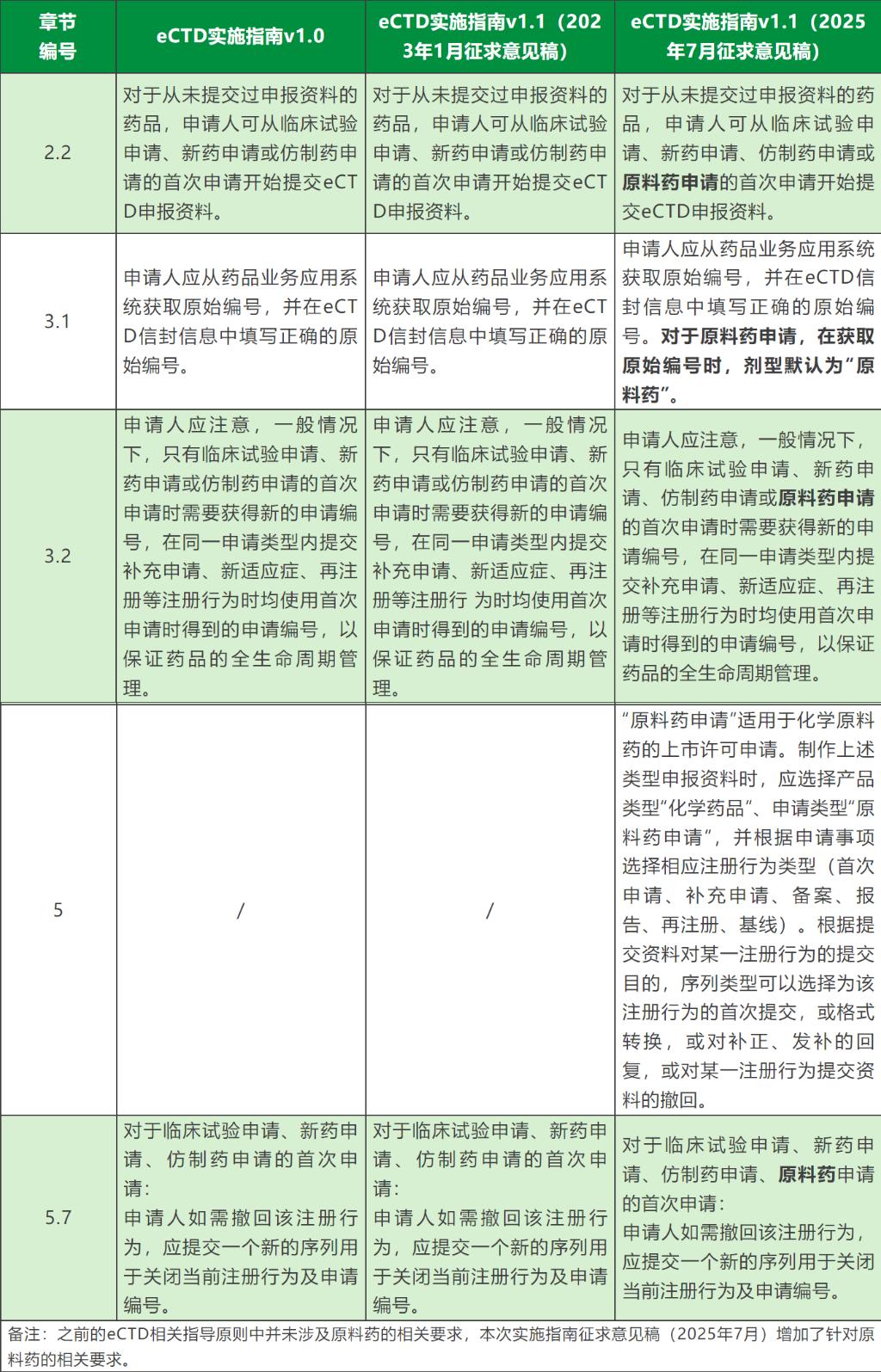
6、增eCTD资料网络传输方式相关描述。
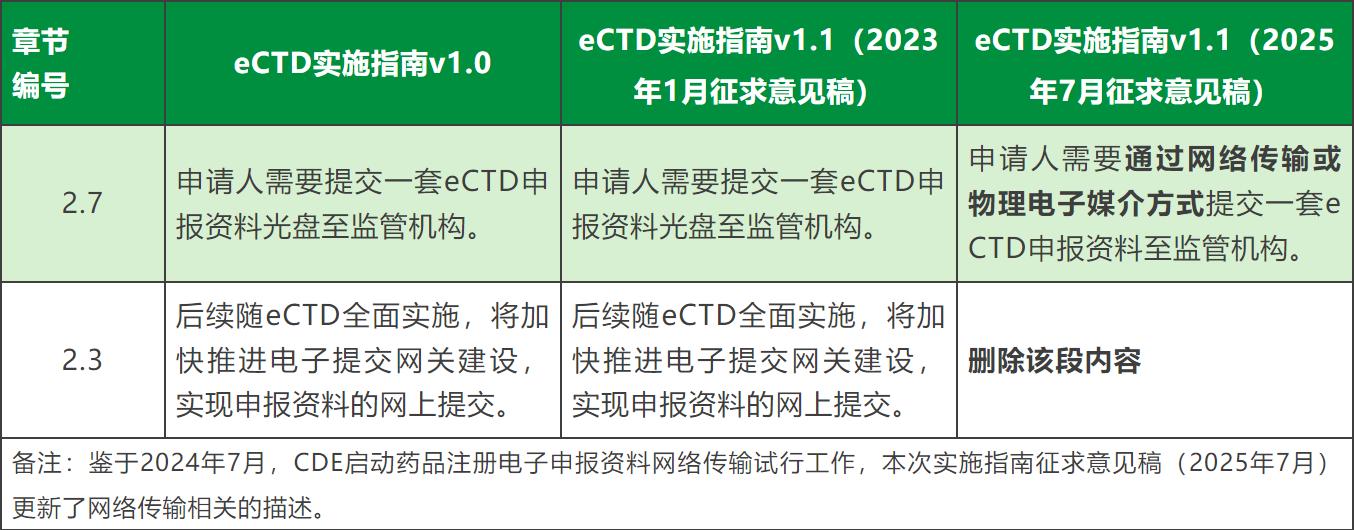
7、其他修订说明中未列出的变更:
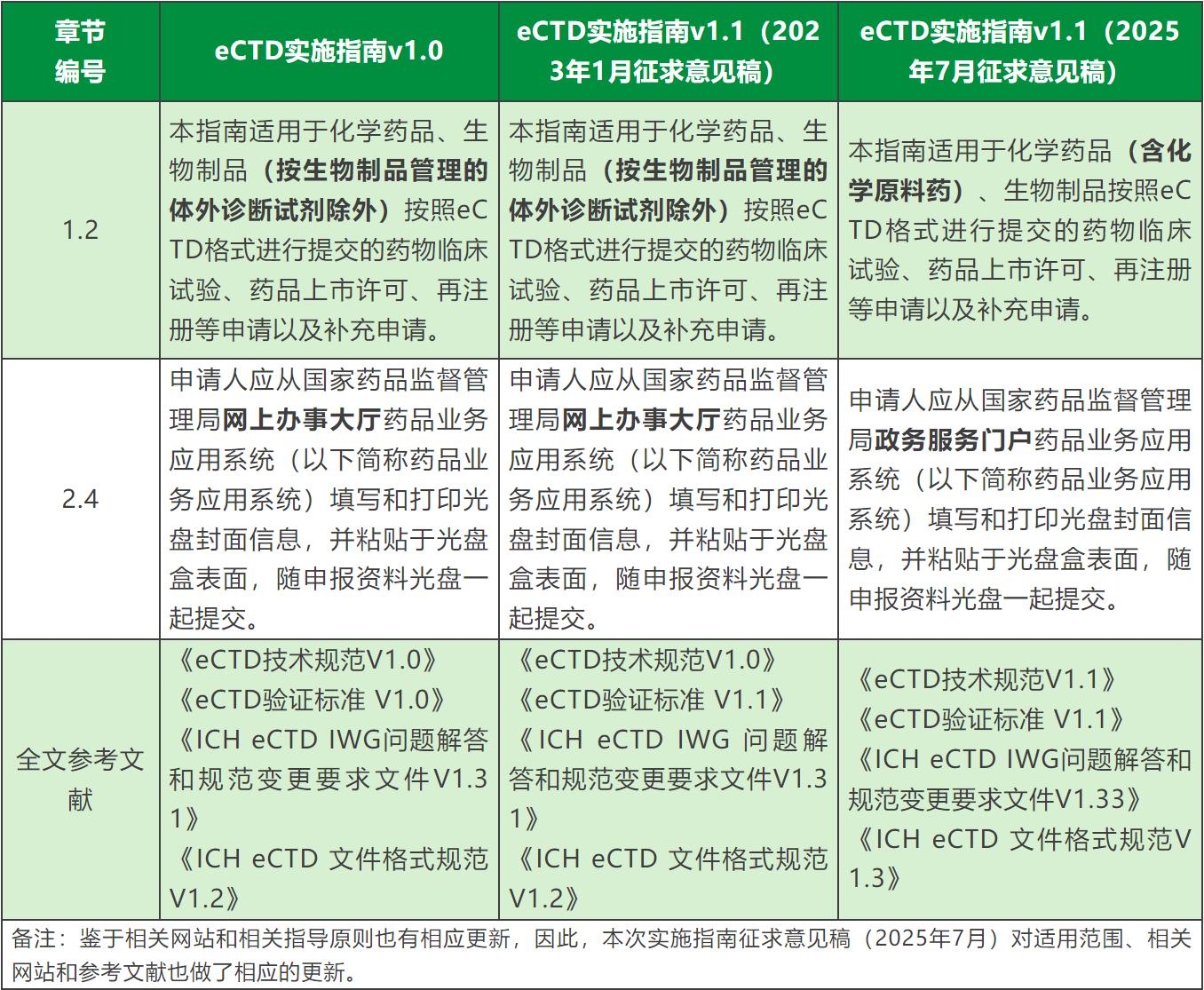
随着我国eCTD规范加速迭代,如何进一步提升药品申报资料质量与申报效率,已成为医药研发企业必须面对的课题。易迪希Clinflash eCTD 凭借其卓越的申报全生命周期管理能力,可为药品研发企业提供专业的全流程技术支撑,已成功帮助多家国内外知名企业高效完成申报。
通过本期文章,易迪希为大家详细总结对比了我国不同阶段的《eCTD实施指南》,后续易迪希还将持续推出《eCTD技术规范》及《eCTD验证标准》的深度对比分析,干货满满,欢迎订阅持续关注!
免责声明:本站所有文章内容,图片,视频等均是来源于用户投稿和互联网及文摘转载整编而成,不代表本站观点,不承担相关法律责任。其著作权各归其原作者或其出版社所有。如发现本站有涉嫌抄袭侵权/违法违规的内容,侵犯到您的权益,请在线联系站长,一经查实,本站将立刻删除。 本文来自网络,若有侵权,请联系删除,如若转载,请注明出处:https://haidsoft.com/184447.html

