大家好,欢迎来到IT知识分享网。
我国药品电子通用技术文档(eCTD)体系日趋完善,其全面实施不仅依赖清晰的技术路径与格式规范,更需依托严格的验证标准,以确保申报文档的严谨性与可靠性。
本文将对eCTD验证标准v1.0与v1.1(征求意见稿)进行详细对比,为企业合规申报提供精准、实用的技术指引。
1、修改验证标准第2.2条,将验证说明由“超出允许大小的文件会提示警告信息。普通单个文件最大允许500MB,单个SAS XPT文件可支持4GB。”调整为“超出允许大小的文件会提示警告信息。普通单个文件最大允许200MB,单个SAS XPT文件可支持4GB。”
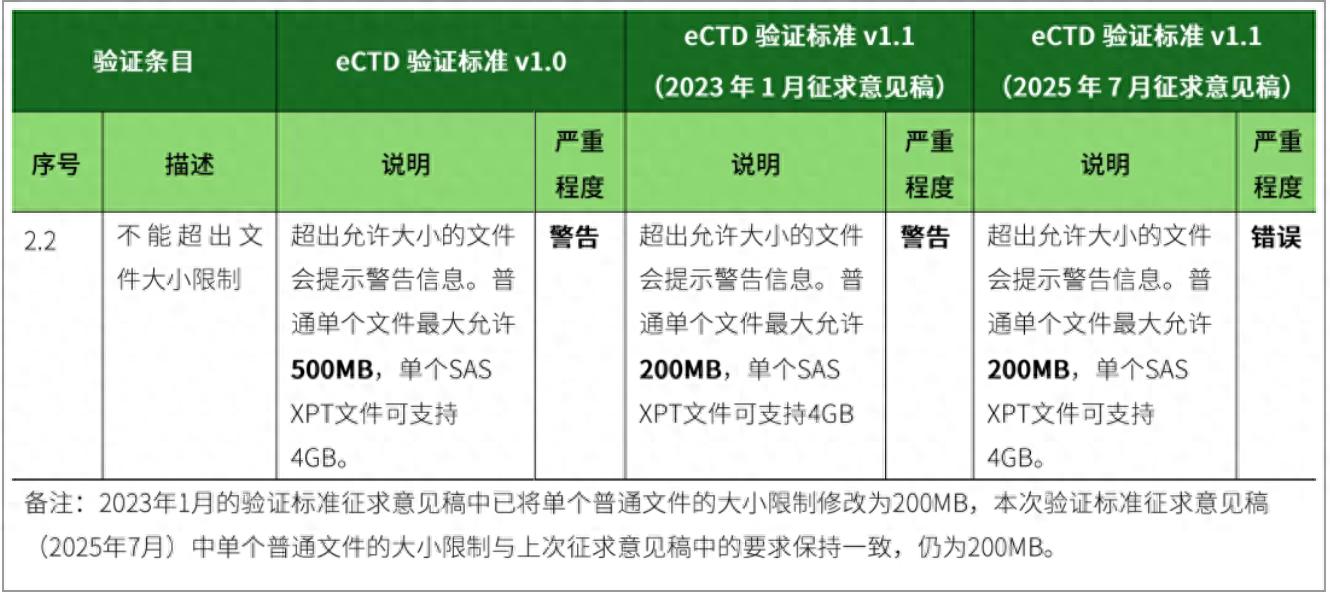
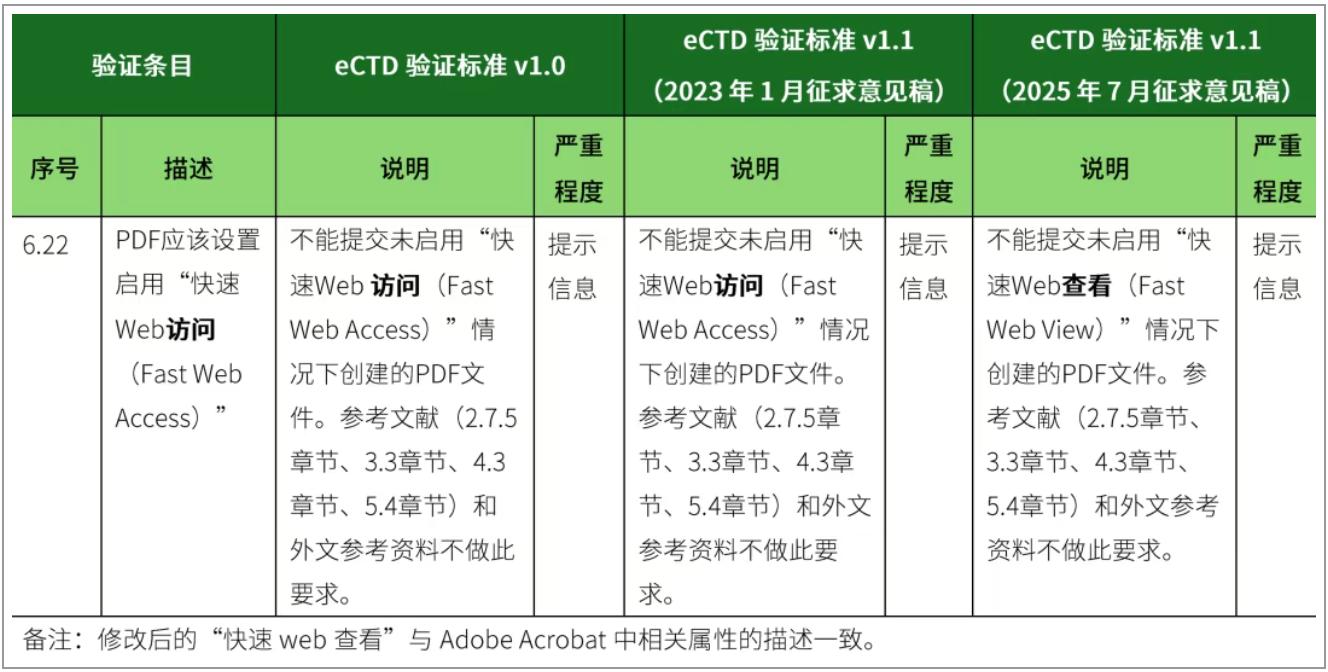
2、修改验证标准第6.22条,将描述“快速Web访问(Fast Web Access)”修改为“快速Web查看(Fast Web View)”。
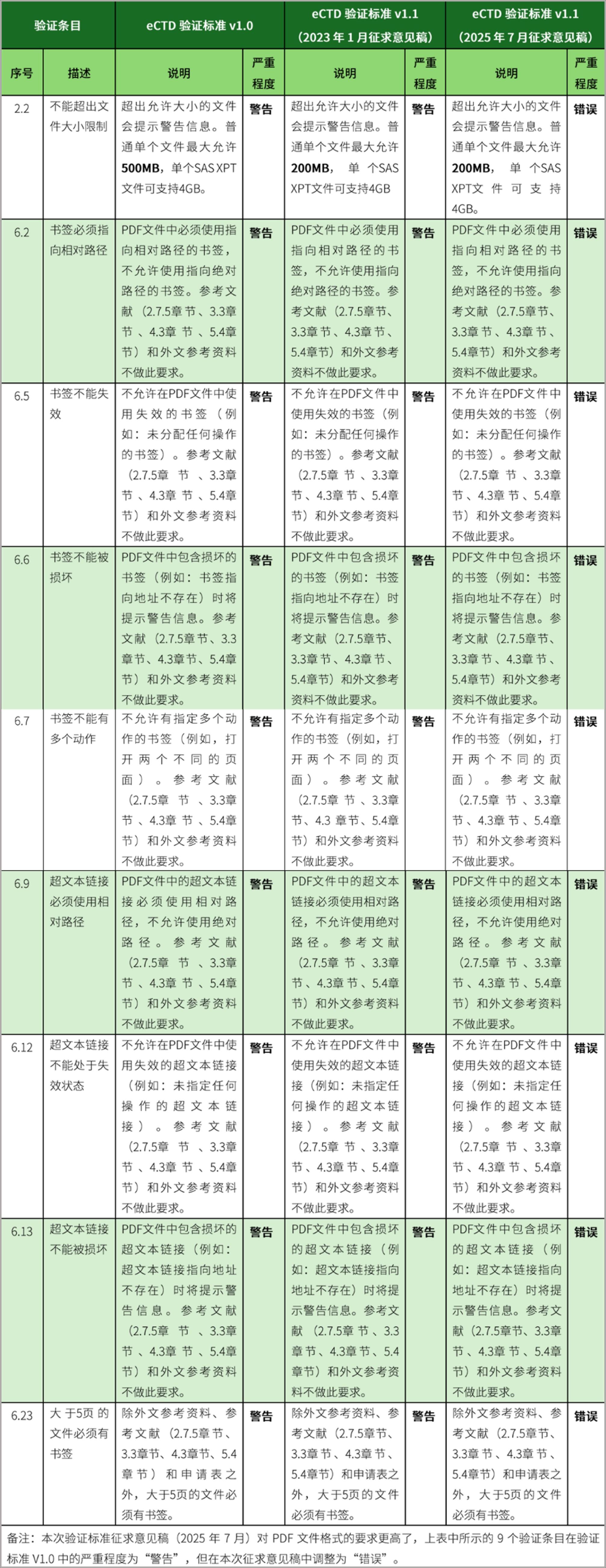
3、调整9条验证标准的严重程度等级,将警告调整为错误。包括2.2、6.2、6.5、6.6、6.7、6.9、6.12、6.13、6.23。
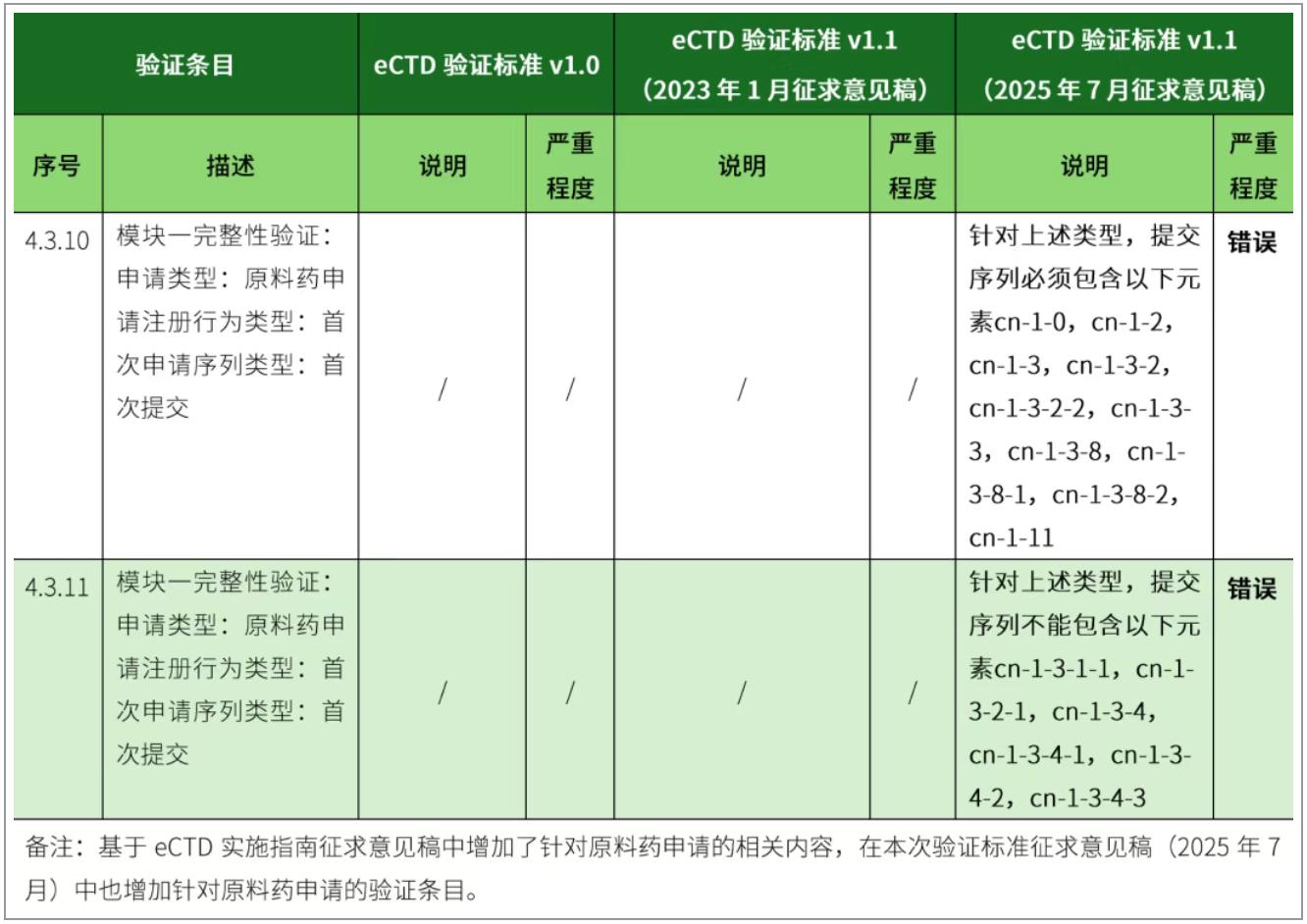
4、新增原料药申请相关验证标准。
eCTD在我国的加速落地,对企业申报能力提出了更高要求。面对复杂的eCTD申报流程与严格的验证标准,选择一款强大可靠的申报工具至关重要。
易迪希Clinflash eCTD系统专为应对eCTD申报的复杂性与合规性挑战而设计,可为药品研发企业提供全面高效的电子申报解决方案,自发布以来深受用户认可。未来,Clinflash eCTD将持续迭代升级,助力更多药企在 eCTD 全面实施的浪潮中驭势前行!
免责声明:本站所有文章内容,图片,视频等均是来源于用户投稿和互联网及文摘转载整编而成,不代表本站观点,不承担相关法律责任。其著作权各归其原作者或其出版社所有。如发现本站有涉嫌抄袭侵权/违法违规的内容,侵犯到您的权益,请在线联系站长,一经查实,本站将立刻删除。 本文来自网络,若有侵权,请联系删除,如若转载,请注明出处:https://haidsoft.com/184462.html

